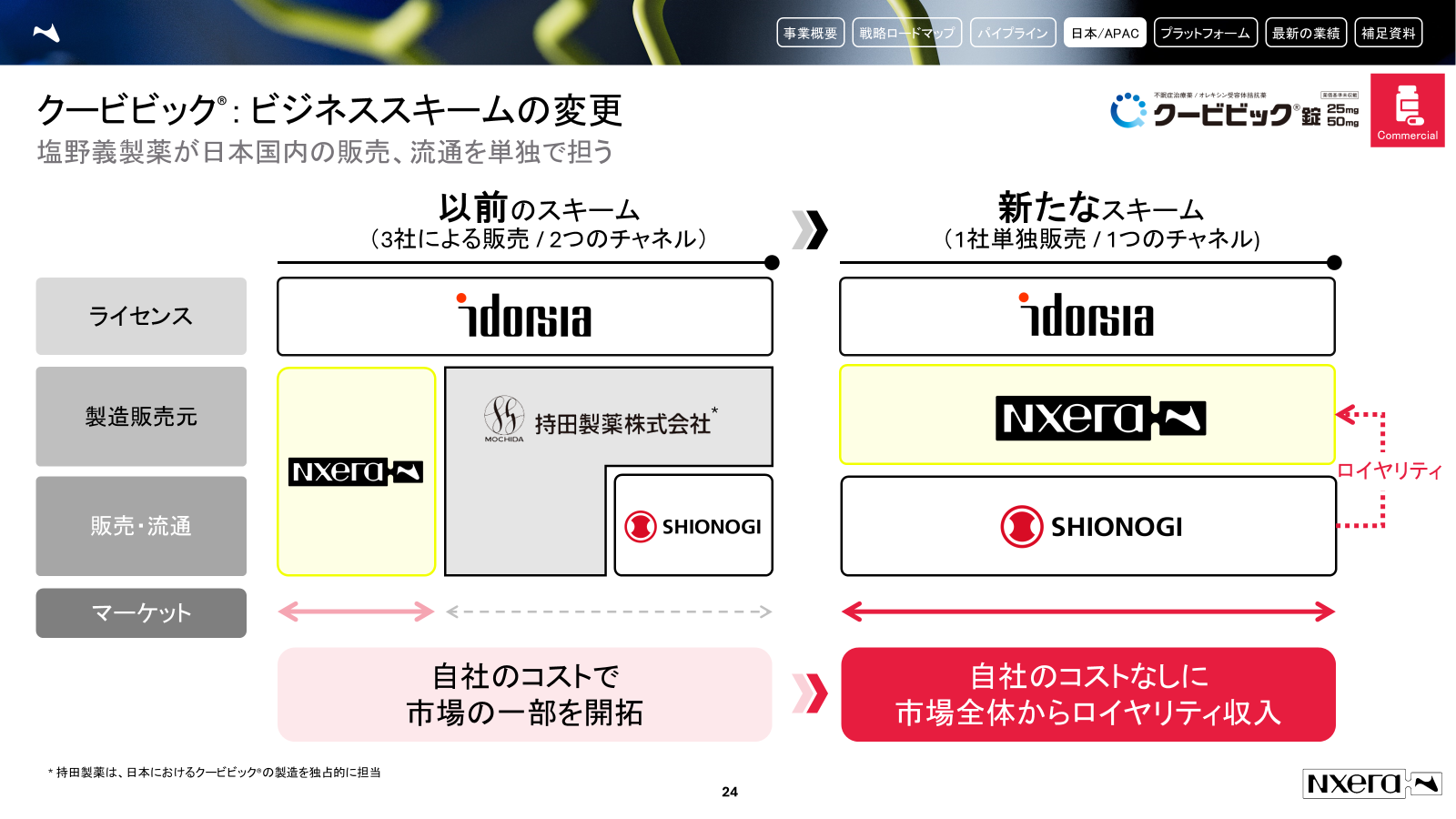
みなさんおはようございます、IR&コーポレートストラテジー部長の田原です。
先ほどのリリースの通り、Centessa社がORX750のPh2試験を開始しました。これにより当社は3.5百万ドル(約5.4億円)を受領します。
Centessa社がリリースに合わせてアップデートしたプレゼンテーション(リンク)の中からいくつかピックアップしてご説明します。ポイントは以下です。
- 10/31時点でのORX750のPh1試験の中間解析データでは、試験したすべての用量で有効性が確認され、安全性・忍容性も良好だった
- ORX750はナルコレプシー1型(NT1)、ナルコレプシー2型(NT2)、特発性過眠症(IH)に対してPh2a試験を開始。2025年内には3つすべての適応症に対するPh2aデータ取得が完了見込み
- 当社との提携から生まれた後続のOX2R作動薬2品目(ORX142、ORX489)のうち、ORX142は前臨床試験中であり、急性睡眠不足の健常人に対する臨床試験の2025年開始を目指す。ORX489については、現在前臨床試験の準備中
- Centessa社はOX2R作動薬ポートフォリオの開発に注力するため、今まで開発を行っていた血友病B向けのSerpin PCプログラムの開発中止を決定
【Centessa社プレゼン P12-13、Ph1中間解析データ(10/31時点)】
【Centessa社プレゼン P15、Ph2a臨床試験デザイン】
NT1、NT2、IHに対するPh2a試験は、有効性に加え安全性・忍容性・薬物動態を評価することを目的としたランダム化二重盲検プラセボ対照クロスオーバー バスケット試験です。初期投与量はNT1では1.0 mg、NT2・IHでは2.0 mgを予定しています。有効性は日中の過度の眠気(MWTおよびESS)、脱力発作(NT1のみ)、全体的な症状改善(NSSおよびIHSS)で評価を予定しています。
各被験者は少なくとも4週間はORX750を投与することを予定しています。また、患者に対する有効性を検証するとともに、最適な投与量の検証を予定しています。これらのデータは2025年中に判明する予定です。
用語・略語- プラセボ対照ランダム化二重盲検試験:治療薬とプラセボを投与する群をランダムに振り分け(ランダム化)、治療薬・プラセボどちらが投与されているか被験者・医療従事者ともにわからなくする(「二重」に盲検)。これにより、被験者・評価者の主観的なバイアスを取り除くことが可能。新薬の臨床試験において一般的に用いられる手法。
- クロスオーバー試験:被験者を2つに分け、別々のものを投与(今回は治療薬・プラセボ)して有効性等を評価したのち、投与するものを入れ替えて再度有効性等を評価する手法。被験者の人数を少なくできるが、試験期間が長くなること、前の治療が残るリスク、などのデメリットもある。
- バスケット試験:ある治療法(今回はOX2R作動薬)を、異なる疾患の被験者(今回はNT1、NT2、IH)に対して同じ試験のもとで評価する手法。同じ遺伝子変異を持つがん(例:肺がん、胃がん、乳がんなど)に対する抗がん剤の臨床試験で良く用いられる手法。
- MWT:覚醒維持検査
- ESS:エプワース眠気尺度
- NSS:ナルコレプシー重症度尺度
- IHSS:特発性過眠症の重症度尺度
Centessa社は、血友病Bの治療薬候補のSerpinPCの自社開発の中止を決定し、2億ドルの開発費を削り、OX2R作動薬ポートフォリオの開発に注力することを発表しています。この資金に加え、2024年9月に実施した公募増資で得た約2.4億ドルの現金をもとに、Centessa社はOX2R作動薬ポートフォリオの開発を加速させることになります。
今後とも、どうぞよろしくお願いします!